美国药物主文件(Drug Master File, DMF)是向FDA提交的机密技术文件,用于支持药品生产、质量控制及合规性审查。以下为申报的要点和流程总结: DMF概述与类型 定义与作用 DMF是药品生产全过程的详细档案,包含原料药、辅料、包装材料等的生产设施、工艺、质量控制等信息,供制剂厂商引用以支持其注册申请。其意义在于保护企业机密的同时,满足FDA对供应链透明度的要求。 DMF类型 Ⅱ类:原料药、中间体及制剂(如微生物外泌体、细胞株等生物制品均属此类)。 Ⅲ类:包装材料。 Ⅳ类:辅料、着色剂等添加剂。 Ⅴ类:非临床/临床数据等特殊信息(需FDA预先批准)。 注:Ⅰ型(生产设施与人员)已于2000年停用。欧盟eCTD注册咨询相关技术支持。上海中国eCTD格式
eCTD的实施为监管机构和企业带来了多重机遇。电子化申报资料能够极大地加速审评效率,减少人为判断错误和数据混淆的情况,从而提高审评的准确性和速度。同时,eCTD带来的数据标准化机遇使得全球监管机构的资料内容和电子格式得以统一,有助于在不同监管机构之间进行数据传输和共享。这对于提升全球监管效率和行业研发效率具有重要意义。此外,eCTD的实施还促进了全球合作,构建了全球监管的底层大数据基础。对于企业而言,eCTD提供了一个规范化的研发活动模板,有助于降低与监管机构沟通的成本,提高申报效率。特别是对于国内的医技术企业而言,eCTD的实施更是具有重要意义,有助于这些企业更好地走向全球市场。然而,中小企业在享受这些机遇的同时,也面临着技术和成本压力。eCTD的实施需要专门的团队进行系统维护和开发,这对于中小企业来说是一笔不小的开支。同时,数据安全问题也是企业关注的焦点。此次CDE扩大eCTD实施范围对行业而言是一个积极的风向标。短期内,企业面临的挑战包括适应更高要求的技术规范并提高文件质量、和eCTD出版系统的磨合以及进行eCTD知识的跨职能培训等。芜湖eCTD使用欧盟ANDA注册申报相关技术支持。
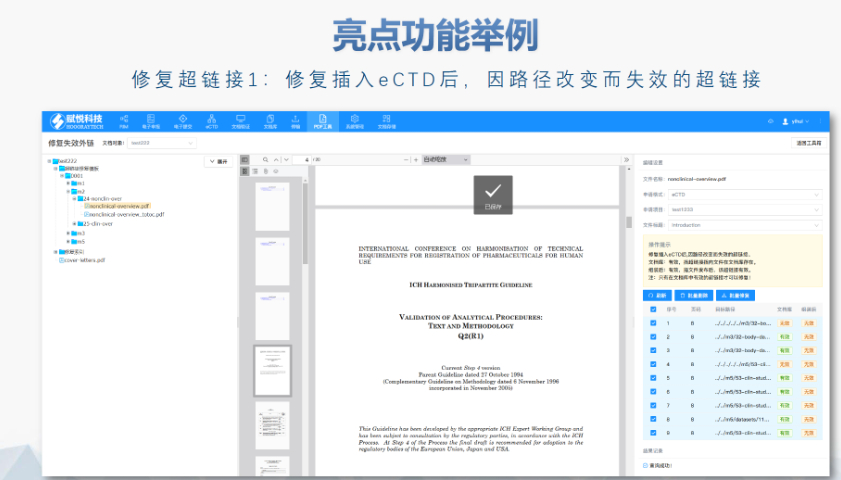
美国eCTD验证采用三级分类:“错误”(必须修正)、“警告”(建议修正)、“提示信息”(参考)。例如,PDF文件版本不符或加密保护属于“错误”,而书签路径非相对性则可能列为“警告”。验证失败将直接导致退审,企业需通过LORENZ Validator等工具预检,确保提交前合规。 技术验证点 验证涵盖XML结构合规性、文件命名规则、生命周期管理(如序列号连续性)及PDF属性(如字体嵌入、可搜索性)。临床试验数据需额外满足CDISC标准,包括SDTM和ADaM数据集的结构验证
区域化差异与多国协作挑战 欧盟eCTD需兼容成员国特定要求,例如模块一的行政信息需符合各国语言和法规差异。互认程序(MRP)中,参考成员国(RMS)的评估报告需被其他成员国认可,若出现分歧需由CMDh协调或提交EMA仲裁。这种多层级审评机制要求申请人在文件准备阶段即考虑区域兼容性,避免后续流程延误。 eCTD4.0的探索与未来方向 ICH于2015年发布的eCTD4.0版本旨在简化目录结构、支持多产品类型(如医疗器械)申报,并增强生命周期管理功能。欧盟计划通过2024年试点逐步过渡至4.0,其扁平化文件组织方式有望减少重复提交并提升审评效率。然而,实施需解决现有系统兼容性及行业适应性问题。瑞士eCTD注册咨询相关技术支持。

GDUFAIII框架与费用分类2022年更的GDUFAIII将费用分为ANDA申请费、DMF认证费、项目费及设施费四类,实施周期至2027年。2025财年ANDA费用至约22万美元,较2024年增幅达,反映审评成本上升。ANDA申请费规则费用需在提交时缴纳,若申请被拒可退还75%。重提交视为申请,需再次缴费。关联API的工厂数量影响总费用,例如某ANDA引用3个API且涉及6家工厂,需支付6倍DMF费用。DMF费用机制II类原料YAODMF需在引用前缴费,一次性支付约(2025财年)。未缴费DMF不得用于支持ANDA,否则触发退审。项目费分级管理根据企业获批ANDA数量分为大、中、小型三级,2025年大型企业年费约34万美元。附属公司ANDA数量合并计算,缴费责任可由母公司或任一附属公司承担。 欧盟eCTD申报软件相关技术支持。江苏ANDAeCTD使用
瑞士eCTD注册申报相关技术支持。上海中国eCTD格式
生命周期管理与变更递交eCTD支持全生命周期管理,申请人需通过序列更(Sequence)反映yao品变更信息。例如CEP的更需提交“变更说明表”,对比已批准和拟修改内容,并附修订版技术文档。重大变更(如生产工艺调整)可能触发GMP现场检查,EDQM将根据feng险评估决定是否启动核查。电子签名与法律效力欧盟接受符合《电子签名法》的数字签名,手写签名的扫描件需嵌入PDF并加密保护。模块1的申请表和承诺书必须包含you效签名,且XML文件需通过MD5校验确保完整性。若使用第三方签署工具,需提前向监管机构报备并获取技术认可。中小企业支持与资源获取EMA和EDQM为中小企业提供eCTD实施指南、验证工具及培训研讨会。例如,EDQM官网发布CEP递交模板和案例库,EMA则定期更Q&A文档以解答常见问题。此外,欧盟设立专项基金,资助中小企业完成eCTD转换和系统部署。 上海中国eCTD格式