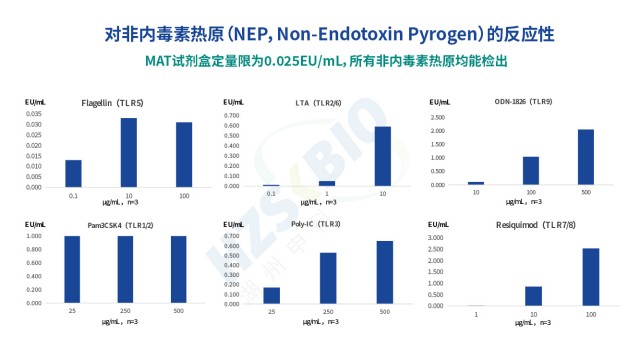
在 MAT 法热原检测中,PBMC(外周血单核细胞)与单核细胞系各有优劣,单核细胞系更适合标准化检测。PBMC 的优势在于免疫细胞成分丰富(含单核细胞、淋巴细胞等),对热原反应敏感,灵敏度相对较高;但局限同样明显 ——PBMC 需从不同供体获取,供体免疫状态差异会导致检测结果不稳定,且无法长期保存,难以建立标准化方法学。单核细胞系(如 HL-60、MM6、THP1)则克服了 PBMC 的局限:细胞来源稳定(可批量培养),TLR 受体表达覆盖主要亚型(如 HL-60 表达 TLR1-TLR9),对热原反应重复性好,更适合商业化试剂盒与法规检测。不同单核细胞系性能也有差异:MM6/IL-6 法检测限约 0.05EU/mL,THP1/TNF-α 法因 TNF-α 为一级免疫效应物检测限更低,但 TNF-α 稳定性差;HL-60/IL-6 法检测限与稳定性均优于前两者,成为主流选择。湖州申科生物MAT试剂盒选用 HL-60 细胞系,正是基于其优异的稳定性与热原响应适配多场景,确保不同批次检测结果一致。
家兔法是热原检测 “金标准”,但操作繁琐、耗时且需动物设施,存在明显局限。广东非动物源热原检测
欧盟在热原检测方法选择上,以动物保护和检测准确性为导向,形成明确的法规倾向。首先,欧盟禁止家兔法(PRT 法)这类动物实验,要求采用替代方法,单核细胞活化试验(MAT 法)因符合 3R 原则(替代、减少、优化),被纳入欧洲药典(EP2.6.30),成为热原检测的主流替代方法。其次,对于鲎试剂法,欧盟虽未禁止(因其属于鲎血提取而非动物实验),但出于鲎资源保护考量,推荐使用重组 C 因子法(EP2.6.32),该方法无需依赖鲎血,通过基因工程技术制备试剂,避免资源衰减与生态争议。此外,美国药典(USP)和日本药典(JP)也同步推荐重组试剂(含重组级联试剂 rCR),形成国际法规协同趋势。需注意的是,欧盟对热原检测的要求是 “重点全场景覆盖致热物质”,MAT 法因能同时检测内毒素与非内毒素热原,重组 C 因子法因特异性高(无 G 因子干扰),均符合其法规逻辑,而传统鲎试剂法需额外关注 β- 葡聚糖假阳性问题,复杂基质样品需加做干扰验证。
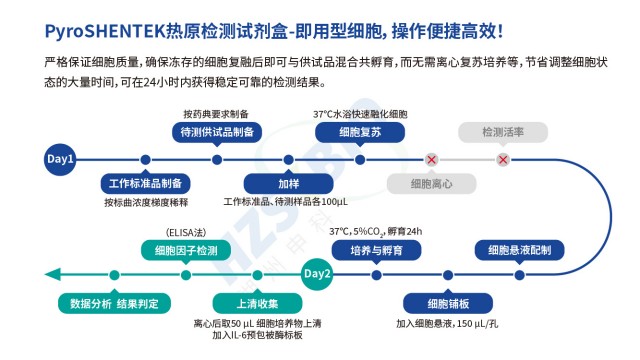
浙江热原检测流程热原检测实验中,标准化培养基与恒定环境让单核细胞系活性稳定,避免PBMC冻存后的功能衰减。
热原检测MAT法的法规地位持续提升,已成为多国药典认可的热原检测替代方法。欧洲药典(EP)是推动 MAT 应用的关键力量:通则 2.6.30 明确 MAT 可替代家兔热原试验(RPT),且能同时检测内毒素与非内毒素热原;2024 年欧洲药典委员会批准删除所有条款中的家兔法,修订文本将于 2025 年7月1日生效,强制鼓励使用 MAT 等体外替代方法。美国药典(USP)<151> 规定,经验证的体外热原试验(如 MAT)可替代家兔法,且需依据 USP<1225>开展验证;FDA 行业指南进一步明确 MAT 的合规性。中国药典 2020 年版通则 9301 将 MAT 列为热原检查的补充方法,虽暂未替代家兔法,但明确其适用于复杂基质样品的全热原筛查。此外,ISO 10993-1、ICCVAM 等国际标准也优先推荐体外热原检测模型,全球法规协同推动 MAT 成为热原检测的主流技术。
MAT法热原检测出现 “无信号”,需从试剂、实验操作、仪器三方面定位原因并解决。试剂层面,抗体不足或失活会导致无法捕获 IL-6,需核对抗体稀释比例,检查保存条件(如 2-8℃)与有效期,必要时更换试剂;底物失效(如变色、沉淀)会无法显色,需观察底物外观,失效则更换;混合不同试剂盒试剂会因成分不匹配导致反应失败,需使用同试剂盒试剂;ELISA 试剂盒保存不当(如反复冻融)会破坏试剂活性,需按说明书分条件保存(如抗体 2-8℃、底物避光)。实验操作中,孵育温度过低(<37℃)会抑制酶促反应,需提前将试剂与孔板平衡至室温,确保孵育温度达标;洗板机压力过高或手动洗涤过猛,会洗去结合的抗体与酶,需调整洗板机压力或轻柔手动洗涤;孵育时孔板未密封导致孔变干,会使反应体系破坏,需用封口膜密封孔板。仪器方面,洗板机喷头堵塞会导致洗涤不均或未洗,需清理喷头;酶标仪波长设置错误(未选 450nm)会无法检测信号,需确认波长设置正确。
基于人体免疫机制的 MAT 热原检测,为热原检测提供了新的可靠途径。
MAT法热原检测中,ELISA 加终止液后的读数时间需严格控制,以保障 IL-6 检测信号稳定。湖州申科生物MAT试剂盒说明书明确要求,终止液添加后需在 10 分钟内完成读数,且需避光操作 —— 原因在于,终止液(如硫酸)会终止 TMB 显色反应,但生成的黄色产物在光照下易降解,超过 10 分钟后 OD 值会下降,导致 IL-6 检测值偏低。读数前需进行 30 秒震荡混匀,确保孔内液体浓度均匀,避免因局部浓度差异导致复孔 OD 值波动。酶标仪波长需设置为 450nm,若仪器含 600nm 参考波长,可同时检测 600nm 波长以扣除背景干扰(如细胞碎片导致的光散射),提升检测准确性。需注意的是,读数时不可覆盖封板膜或盖子,避免膜上凝结的水蒸气滴入孔中,导致 OD 值异常升高。若因仪器故障无法及时读数,需将微孔板密封后置于 4℃避光保存,并在 30 分钟内完成读数,同时在记录中注明延迟原因,评估延迟对结果的影响(如延迟 20 分钟,OD 值可能下降 15%,需校正后使用)。
MAT热原检测通过热原活化单核细胞释放促炎细胞因子,再经ELISA定量 IL-6判断供试品是否合格。广东非动物源热原检测
进行热原实验时,样品有效稀释倍数上限应通过干扰实验确定,既保护细胞活性又保证热原检测灵敏度。广东非动物源热原检测
中国药典对 MAT 法热原检测要求 4 复孔,未明确 CV 限值,需结合细胞实验特性合理解读与操作。药典不设 CV 限值的主要原因是:MAT 法基于细胞反应,细胞活性易受环境微小变化(如温度、pH)影响,存在天然不稳定性,过严的 CV 要求可能脱离实际;但实验室可通过积累多批次数据,制定内部 CV 控制范围(如定量上下限 CV≤30%、25%),确保检测重复性。关于 3 复孔的适用性:若长期数据显示 CV 控制良好(如连续 10 批次 CV<20%),且样品为中间过程检测(非 QC 放行),可尝试 3 复孔,但需同步设置加标对照,验证结果可靠性;若为 QC 放行检测,仍建议按 4 复孔操作,符合药典下限要求。对于异常点处理,可采用狄克逊准则(Q 检验)等统计学方法 —— 如某复孔 IL-6 检测值偏离平均值 30% 以上,且无明显操作误差(如加样错误),可判定为异常点并剔除,但需在原始记录中详细说明原因,确保数据可追溯,避免随意剔除导致结果失真。
广东非动物源热原检测