- 产地
- 苏州
- 品牌
- 外泌体提取试剂
- 型号
- 齐全
- 是否定制
- 是
外泌体的提取方法:1.超速离心法(差速离心)。超离法是较常用的外泌体纯化手段,采用低速离心、高速离心交替进行,可分离到大小相近的囊泡颗粒。超离法因操作简单,获得的囊泡数量较多而广受欢迎,但过程比较费时,且回收率不稳定(可能与转子类型有关),纯度也受到质疑;此外,重复离心操作还有可能对囊泡造成损害,从而降低其质量。2.密度梯度离心。在超速离心力作用下,使蔗糖溶液形成从低到高连续分布的密度阶层,是一种区带分离法。通过密度梯度离心,样品中的外泌体将在1.13-1.19g/ml的密度范围富集。此法获得的外泌体纯度较高,但步骤繁琐,耗时,对离心时间极为敏感。外泌体的提取分离:超滤离心。宁波外泌体提取试剂服务电话

外泌体的提取方法:1、色谱法。色谱法是利用根据凝胶孔隙的孔径大小与样品分子尺寸的相对关系而对溶质进行分离的分析的方法。样品中大分子不能进入凝胶孔,只能沿多孔凝胶粒子之间的空隙通过色谱柱,首先被流动相洗脱出来;小分子可进入凝胶中绝大部分孔洞,在柱中受到更强地滞留,更慢地被洗脱出。分离到的外泌体在电镜下大小均一,但是需要特殊的设备,应用不普遍。2、超滤离心。由于外泌体是一个大小约几十纳米的囊状小体,大于一般蛋白质,利用不同截留相对分子质量(MWCO)的超滤膜对样品进行选择性分离,便可获得外泌体。超滤离心法简单高效,且不影响外泌体的生物活性,是提取细胞外泌体的一种新方法。重庆正规外泌体提取试剂哪里买外泌体提取:基于聚合物的沉淀技术。

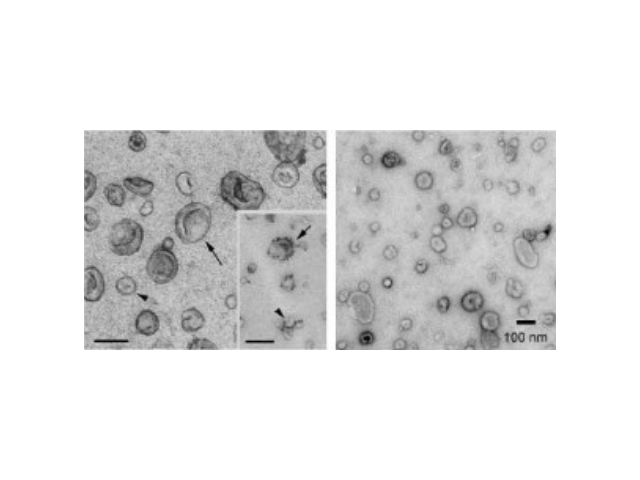
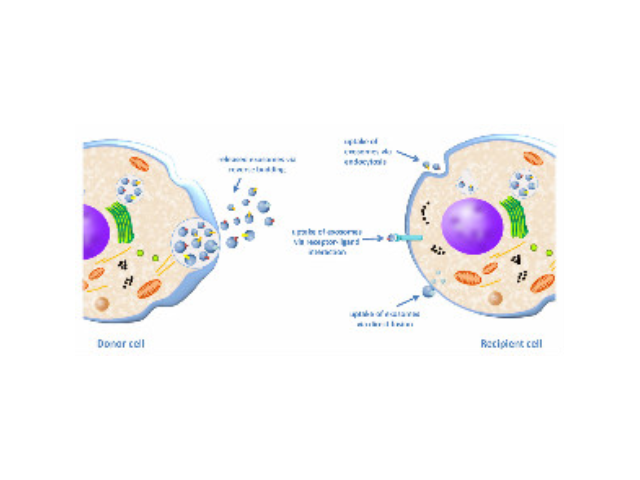
外泌体可通过流式、WB(检测指标有CD9,CD63,CD81)、电镜观察、NTA粒径追踪等手段检测,普遍应用于药物载体、疾病诊断marker、精细医疗、一些病症治病等方面研究。由于外泌体直径小,样本含量低,提取十分困难。已有的外泌体分离方式有密度梯度离心、超滤离心法、免疫磁珠抗体捕获、商用试剂盒等。但到目前为止,仍没有一种提取方法能同时保证外泌体的含量、纯度以及生物活性。外泌体是细胞间进行物质运输和信息交流的重要工具,可以通过调节免疫功能促进一些病症的增殖,血管新生和一些病症转移。与细菌传染,帮助细菌逃避免疫关系很大,并与心血管疾病,老年痴呆等疾病具有密切关系。
外泌体研究思路。外泌体研究通常与高通量测序的联系紧密,研究思路可以分为三大类:表达谱、分子标志物和分子机制方向,其中表达谱思路的特点就是短平快、通常以测序数据为主要内容,短平快发表3-5分文章。而分子标志物的特点是在表达谱基础之上加入大量样本验证,建立ROC、KM曲线,分析分子与临床疾病的相关性为主,通常文章影响因子在3-10分之间。分子机制研究,顾名思义要做到细胞功能、机制研究深度,因此工作量通常较大,影响因子通常能够上10+。唐山正规外泌体提取试剂产品介绍在体内参与细胞通讯、细胞迁移、促血管新生和抗一些病症免疫等生理过程,与多种疾病的发生和进程密切相关。外泌体提纯试剂盒的特色与优势:外泌体被纯化并且不含任何其他RNA结合蛋白。

外泌体的提取、分离方法:超高速离心法。常用的是超高速离心法,该方法是被誉为分离外泌体的“金标准”。该方法利用离心力从细胞培养液或生物流体获得外泌体,经过400×g、2000×g、10000×g的低速离心,除去细胞及大的细胞分泌物;较后超高速100000×g离心得到外泌体[12]。超高速离心因操作简单,不需要复杂的技术支持,并且成本相对较低而被普遍使用。但是该方法耗时、产率低,得到的外泌体的数量和质量很大程度上受转子的类型、转子沉降角度等因素影响,其中较主要的问题就是差速离心法获得的沉淀物是外泌体,但也会有其他的囊泡、蛋白质或蛋白和RNA的聚集体。外泌体的提取分离:超速离心法(差速离心)。昆明正规外泌体提取试剂单价
外泌体提取:尺寸排阻色谱可以精确分离大小分子。宁波外泌体提取试剂服务电话
外泌体的提取方法:1、磁珠免疫法。外泌体表面有其特异性标记物(如CD63、CD9蛋白),用包被抗标记物抗体的磁珠与外泌体囊泡孵育后结合,即可将外泌体吸附并分离出来。磁珠法具有特异性高、操作简便、不影响外泌体形态完整等优点,但是效率低,外泌体生物活性易受pH和盐浓度影响,不利于下游实验,难以普遍普及。2、多聚物沉淀法。聚乙二醇(PEG)为常用的多聚物,可与疏水性蛋白和脂质分子结合共沉淀,早先应用于从血清等样本中收集病毒,现在也被用来沉淀外泌体,其原理可能与竞争性结合游离水分子有关。利用PEG沉淀外泌体存在不少问题:比如纯度和回收率低,杂蛋白较多(假阳性),颗粒大小不均一,产生难以去除的聚合物,机械力或者吐温-20等化学添加物将会破坏外泌体等。宁波外泌体提取试剂服务电话
用于外泌体提取的体液收集注意事项:1、选择血清还是血浆?推荐大多数研究选择血浆。血液凝固过程中血小板会产生大量外泌体,含量占血清中外泌体的50%以上,选择血浆可避免不必要的影响。2、注意抗凝剂的选择。肝素类抗凝剂与PCR假阴性有关,这可能是因为肝素与引物和/或酶有竞争作用。除了克制PCR,肝素可以与外泌体结合,阻止细胞摄取外泌体。因此需要记录肝素类药物的患者的血液样本。EDTA和双嘧达莫(CTAD),CTAD可以阻止血小板的并克制其释放外泌体。EDTA可能会干扰PCR反应(尽管其程度小于肝素),但是还是优于其他选择。此外,有研究表明钙螯合剂可在体外促进外泌体与血小板的结合从而降低经EDTA、或...
- 外泌体提取试剂厂家供应 2026-02-28
- 宁波外泌体提取试剂厂家推荐 2026-02-27
- 开封外泌体提取试剂厂家直销 2026-02-27
- 石家庄外泌体提取试剂平均价格 2026-02-27
- 温州正规外泌体提取试剂单价 2026-02-27
- 贵阳外泌体提取试剂单价 2026-02-27
- 芜湖外泌体提取试剂厂家推荐 2026-02-26
- 宁波正规外泌体提取试剂厂家批发价 2026-02-26
- 北京外泌体提取试剂销售厂家 2026-02-26
- 武汉正规外泌体提取试剂销售厂家 2026-02-26
- 温州外泌体提取试剂厂家推荐 2026-02-26
- 郑州外泌体提取试剂供应商 2026-02-26
- 开封外泌体提取试剂价格 2026-02-25
- 开封正规外泌体提取试剂单价 2026-02-25
- 济南正规外泌体提取试剂产品介绍 2026-02-25
- 厦门外泌体提取试剂厂家直销 2026-02-25


- 郑州正规无血清细胞冻存液厂家现货 03-02
- 金华重庆原代细胞分离试剂盒 03-02
- 南京正规无血清细胞冻存液哪里买 03-02
- 武汉正规无血清细胞冻存液产品介绍 03-02
- 唐山正规无血清细胞冻存液厂家批发价 03-02
- 珠海正规无血清细胞冻存液厂家推荐 03-02
- 珠海无血清细胞冻存液哪里买 03-02
- 济南细胞高效转染试剂厂家推荐 03-02
- 苏州无血清细胞冻存液厂家 03-02
- 青岛正规细胞高效转染试剂厂家批发价 03-02