- 产地
- 苏州
- 品牌
- 外泌体提取试剂
- 型号
- 齐全
- 是否定制
- 是
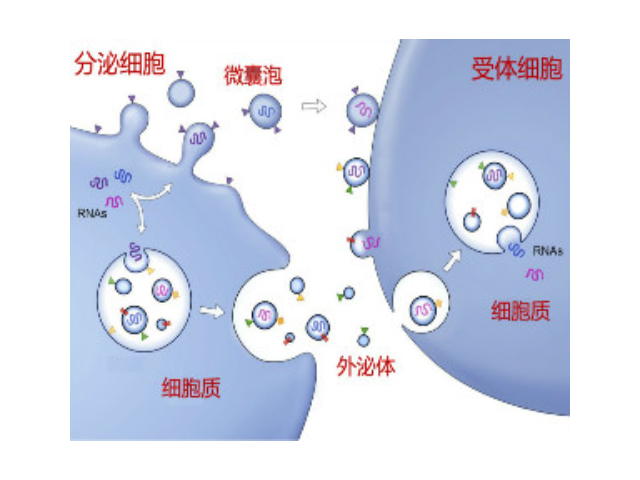
外泌体的生物学功能研究中需要分离完整的外泌体颗粒,而传统超速离心方法步骤繁琐、硬件要求高、操作难度大。李记生物自主开发的外泌体快速提取试剂盒,组分经过优化处理,适用于细胞培养上清液、血清、血浆、尿液及其他体液(脑脊液、腹水、羊水、乳汁以及唾液等)中的外泌体提取,并搭配纯化过滤装置,可快速高效地获得高纯度外泌体颗粒。注意事项:1.对于待测样品粘度过大时,可将样本用4℃预冷的1×PBS缓冲液进行等体积稀释处理。2.当血清、血浆、唾液等样品收获的外泌体浓度较高,收获的外泌体颗粒无法通过EPF柱纯化时,可用4℃预冷的1×PBS进行稀释后再通过EPF柱离心。3.针对外泌体标志蛋白(CD63,CD9,CD81等)进行Westernblot检测,可以鉴定所提的外泌体。通过超速离心(120000g/分钟)20小时以上才能获得足够的外泌体量。用于外泌体提取的体液收集注意事项:选择血清还是血浆?推荐大多数研究选择血浆。温州外泌体提取试剂

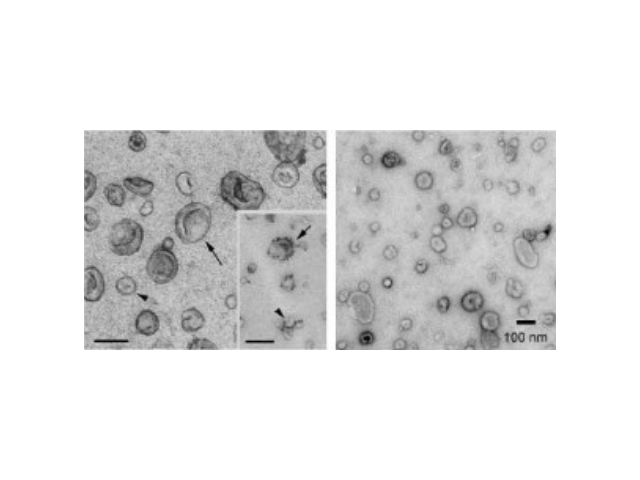
外泌体提取:尺寸排阻色谱。尺寸排阻色谱(Size-exclusionchromatography,SEC)是基于大小而非分子量实现分离大分子。该技术应用填充多孔聚合物微球的柱子,分子根据其直径通过微球,半径小的分子需要更长的时间才能通过色谱柱的孔隙迁移,而大分子则从色谱柱中更早地洗脱。尺寸排阻色谱可以精确分离大小分子。此外,可以将不同的洗脱溶液应用于该方法。与离心方法相比,色谱分离已被证明具有更多优势,因为通过色谱分离的外泌体不受剪切力的影响,这可能会改变囊泡的结构。目前,SEC是一种普遍接受的分离血液和尿液中外泌体的技术。不过,该方法耗时较长,不适合大量样本处理。石家庄正规外泌体提取试剂哪家便宜外泌体提取:重复离心操作还有可能对囊泡造成损害,从而降低其质量。

外泌体相关miRNA与肺病的诊断:miRNAs是一类含有20~25个核苷酸的非编码小RNA,能够通过下调或压制靶mRNAs来调节转录水平上的基因表达,目前非编码RNA被普遍发现存在于NSCLC患者外泌体中,参与一些病症的形成和演化过程。单个miRNA可能通过压制性复合物与多个mRNA结合,从而阻滞整个生物通路。因此,外泌体的miRNA具有成为NSCLC标志物的优势。Chen等在152例肺病患者的研究中初次报道了循环游离miRNA的表达,与75例健康者相比,发现了两种高表达的miRNA(miR-25和miR-223)。Rabinonowits等对27例肺病患者和9例健康人的血浆外泌体中12个miRNA的表达进行了评估,结果显示,12个一些病症相关的miRNA*在肺病患者中过度表达。Cazzoli等收集了30个血浆样本,发现4种外泌体miRNA(miR-378a、-379a、-139-5p、-200b-5p)在肺病患者血清中明显升高,用于筛查患者与健康人ROC曲线下面积(AUC)为0.908。离心除去细胞器,留取上清。
外泌体的提取、分离方法:免疫亲和层析法。免疫亲和层析法是利用生物体内存在的抗原、抗体之间高度特异性的亲和力进行分离的方法,主要用于生物大分子的分离、纯化。将其应用于外泌体的分离主要是借助外泌体表面的特异性抗体,如TSG101或四跨膜蛋白。此方法的原理是利用抗原抗体的特异性结合,只有囊泡表面有特异性的抗体才可以被识别,这使得提取的外泌体纯度高,但是产量低。Zarovni等分别用超速离心、密度梯度离心和免疫层析法,从血浆和细胞上清中提取外泌体蛋白,结果表明,免疫亲和层析法得到的外泌体表面存在多种标记蛋白(Alix、CD9、CD63),同时,ELISA和PCR结果也证明了该方法的可行性。外泌体提取:超离法是较常用的外泌体纯化手段,采用低速离心、高速离心交替进行。

研究探讨了外泌体是否可以作为RNAi的有效载体的可能性。与脂质体和其他合成药物纳米颗粒载体不同,外泌体含有可能增强内吞作用的跨膜和膜锚定蛋白,从而促进其内容物的递送。CD47是外泌体蛋白质之一,是一个普遍表达的整合素相关跨膜蛋白,其部分功能可以保护细胞免受吞噬作用。CD47是信号调节蛋白α(SIRPα,也称为CD172a)的配体,CD47-SIRPα间的结合能够发出“不要吃我”的信号,从而压制吞噬作用。病基因RAS能够促进胰腺病细胞增殖,增强胞饮作用从而促进一些病症细胞摄取外泌体。合成纳米颗粒对细胞有一定毒性作用,但使用外泌体能够较小化对细胞的毒性。研究人员发现,CD47和病基因KRAS驱动的胞饮作用都会压制外泌体被循环系统的清理,并增强胰腺病细胞对外泌体的特异性。所以,外泌体的这种特性增强了它们通过递送RNAi来特异性靶向胰腺病中的KRAS的能力,并且使用外泌体作为单一靶向剂显着改善了所有实验PDAC小鼠模型的总生存期。外泌体提取:具有高粘度的生物样品。珠海外泌体提取试剂生产厂家
外泌体提取:高速离心以消除更大的囊泡。温州外泌体提取试剂
外泌体相关技术在过去几年一直在快速发展,预计市场将大幅增长,因为它们可被应用到液体活检、精细医学和再生医学领域。特别是,一些疾病衍生的外泌体通过调节血管生成、转移和免疫来影响细胞的侵袭性,使其成为用于一些疾病检测、诊断和治病选择的极其有用的生物标志物来源。在风险投资方面,有很多市场活动。2016年1月,ExosomeDiagnostics公司在B轮融资中获得6000万美元资金,并于2017年7月获得3000万美元的C轮融资。同样,CodiakBiosciences公司于2016年由MDAnderson一些疾病中心与两家风险投资公司共同成立,以8000多万美元的A和B轮融资成立该公司。2017年11月29日,CodiakBioSciences公司又增加了7650万美元的C轮融资。在整个A、B和C轮融资中,CodiakBioSciences公司募集了惊人的1.685亿美元。温州外泌体提取试剂
1983年,外泌体初次于绵羊网织红细胞中被发现,1987年Johnstone将其命名为“exosome”。多种细胞在正常及病理状态下均可分泌外泌体。其主要来源于细胞内溶酶体微粒内陷形成的多囊泡体,经多囊泡体外膜与细胞膜融合后释放到胞外基质中。所有培养的细胞类型均可分泌外泌体,且外泌体天然存在于体液中,包括血液、唾液、尿液、脑脊液和乳汁中。有关他们分泌和摄取及其组成、“运载物”和相应功能的精确分子机制刚刚开始研究。外泌体目前被视为特异性分泌的膜泡,参与细胞间通讯,对外泌体的研究兴趣日益增长,无论是研究其功能还是了解如何将其用于微创诊断的开发。如何高效地提取外泌体是实现这项新兴液体活检技术临床常规...
- 南昌外泌体提取试剂价格 2026-01-09
- 芜湖外泌体提取试剂进货价 2026-01-08
- 合肥正规外泌体提取试剂推荐厂家 2026-01-08
- 徐州正规外泌体提取试剂生产厂家 2026-01-08
- 珠海外泌体提取试剂直销厂家 2026-01-08
- 贵阳外泌体提取试剂厂家推荐 2026-01-08
- 石家庄正规外泌体提取试剂厂家推荐 2026-01-07
- 开封正规外泌体提取试剂单价 2026-01-07
- 杭州正规外泌体提取试剂厂家推荐 2026-01-07
- 珠海正规外泌体提取试剂服务电话 2026-01-07
- 深圳正规外泌体提取试剂推荐厂家 2026-01-06
- 重庆正规外泌体提取试剂单价 2026-01-06
- 厦门正规外泌体提取试剂报价 2026-01-06
- 重庆正规外泌体提取试剂厂家推荐 2026-01-06
- 唐山外泌体提取试剂 2026-01-05
- 南昌外泌体提取试剂厂家批发价 2026-01-05


- 苏州正规原代细胞分离试剂盒进货价 01-11
- 安徽品牌糖原染色试剂盒量大从优 01-10
- 上海口碑好的糖原染色试剂盒 01-10
- 山东正规糖原染色试剂盒厂家直销 01-10
- 成都细胞高效转染试剂哪家便宜 01-10
- 福建咨询糖原染色试剂盒厂家直销 01-10
- 太原鼠尾胶原产品介绍 01-10
- 如何使用糖原染色试剂盒生产厂家 01-10
- 金华天津原代细胞分离试剂盒 01-10
- 贵阳细胞高效转染试剂报价 01-10