双光子吸收理论早在1931年就由诺奖得主MariaGoeppertMayer提出,30年后因为有了激光才得到实验验证,但是到WinfriedDenk发明双光子显微镜又用了将近30年。要理解双光子的技术挑战和飞秒激光发挥的重要作用,首先要了解其中的非线性过程。双光子吸收相当于和频产生非线性过程,这要求极高的电场强度,而电场取决于聚焦光斑大小和激光脉宽。聚焦光斑越小,脉宽越窄,双光子吸收效率越高。对于衍射极限显微镜,聚焦在样品上的光斑大小只和物镜NA和激光波长有关,所以关键变量只剩下激光脉宽。基于以上分析,能够以高重频(100MHz)输出超短脉冲(100fs量级)的飞秒激光器成了双光子显微镜的标准激发光源。这也再次说明双光子显微镜的优势:只有焦平面处才能形成双光子吸收,而焦平面之外由于光强低无法被激发,所以双光子成像更清晰。WinfriedDenk初使用的光源是染料飞秒激光器(100fs脉宽、630nm可见光波长)。虽然染料激光器对于实验室演示尚可,但是使用很不方便所以远未实现商用。很快双光子显微镜的标配光源就变成了飞秒钛宝石激光器。除了固态光源优势,钛宝石激光器还具有较宽的近红外波长调谐范围,而近红外相比可见光穿透更深,对生物样品损伤更小。上海双光子显微镜就找因斯蔻浦。国外布鲁克双光子显微镜光子探测

相比普通的显微镜电子显微镜可以观察尺度更小的东西,冷冻电镜更是可以观察有活性的生物大分子,而双光子显微镜有什么优势呢?它能做到什么普通光学显微镜做不到的事情吗?原来,双光子显微镜可以精确穿透较厚标本进行定点、***观察!由于电磁波的波长越短,粒子性越强,受散射影响也就越大。双光子显微镜将激发光源改为长波长激光,在增加了激光的穿透性的同时还减少了对细胞的毒性。除此之外,因为只有物镜焦点处能发生双光子激发效应,所以扫描的精确度极高,也能提高激发光效率,减少被扫描点之外的荧光物质消耗。美国荧光双光子显微镜成像视野双光子显微镜的应用中,该如何选择以及更好的使用PMT。
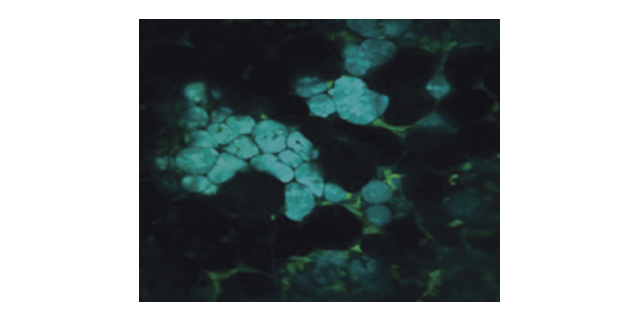
为了验证动物生物样品的时间分辨成像能力,本实验观察了活海拉细胞高尔基体中的青色荧光蛋白mTFP1,见图3(a),(c)-(i)。使用的物镜及尺寸与荧光颗粒成像一致,对比可见v2PE在空间分辨率、激发深度级图像对比度较常规宽场显微镜都有所提高。此外,v2PE可以同时激发多个波长的荧光蛋白,这种技术还可以应用于细胞内分子的三维动力学多色成像。在此基础上,实验对海拉细胞中的高尔基体(mTFP1)和纤颤蛋白(EGFP)进行了在体成像,见图3(j)-(n),青色为mTFP1,绿色为EGFP,实验中两种荧光蛋白同时成像,终采用光谱分离法将不同蛋白的荧光信号分离出来。
细胞内钙离子作为重要的信号分子其作用具有时间性和空间性。当个细胞兴奋时,产生了一个电冲动,此时,细胞外的钙离子流入该细胞内,促使该细胞分泌神经递质,神经递质与相邻的下一级神经细胞膜上的蛋白分子结合,促使这一级神经细胞产生新的电冲动。以此类推,神经信号便一级一级地传递下去,从而构成复杂的信号体系,终形成学习、记忆等大脑的高级功能。在哺乳动物神经系统中,钙离子同样扮演着重要的信号分子的角色。静息状态下大部分神经元细胞内钙离子浓度约为50-100nM,而细胞兴奋时钙离子浓度能瞬间上升10-100倍,增加的钙离子对于突触囊泡胞吐释放神经递质的过程必不可少。众所周知,只有游离钙才具有生物学活性,而细胞质内钙离子浓度由钙离子的内外流平衡所决定,同时也受钙结合蛋白的影响。细胞外钙离子内流的方式有很多种,其中包括电压门控钙离子通道、离子型谷氨酰胺受体、烟碱型胆碱能受体(nAChR)和瞬时受体电位C型通道(TRPC)等。神经元钙成像的原理就是利用特殊的荧光染料或钙离子指示剂将神经元中钙离子浓度的变化通过荧光强度表现出来,以反映神经元活性。该方法可以同时观察多个功能或位置相关的脑细胞。双光子显微镜有哪些应用呢?

双光子显微镜是激光扫描共聚焦显微镜和双光子激发技术相结合的新技术。双光子激发的基本原理是:在光子密度较高的情况下,荧光分子可以同时吸收两个波长较长的光子,经过短暂的所谓激发态寿命后,发射一个波长较短的光子;效果和用波长为长波长一半的光子激发荧光分子是一样的。双(多)光子成像的优点是具有更深的组织穿透深度,红外光可以在平面上探测到极限为1mm的组织区域;因为信号背景比高,所以具有更高的对比度;由于激发体积小,具有定点激发、光毒性小的特点;激发波长由紫外、可见光调整为红外激发,更加安全。双光子显微镜能够进行光裂解、光转染和光损伤等光学操纵。激光双光子显微镜代理商
双光子显微镜可以在小鼠的的任何部位进行有生命体成像。国外布鲁克双光子显微镜光子探测
单光子显微技术是成熟的荧光显微技术,但由于其使用的激发光波长较短,成像深度有限;能量较大,会造成对荧光物质的漂白,光毒性严重。激光共焦扫描显微镜由于共焦显微镜的孔径很小,实现样本三维成像要逐点扫描,成像速度慢,对样本损害大,很难用于长时间活细胞成像。而宽场显微镜能够很好地实现实时动态成像,光漂白小,因而较早应用于活细胞内的实时检测,但宽场显微镜由于离焦信号的干扰,难以实现多维成像。双光子荧光显微镜(Two-PhotonLaser-ScanningMicroscopy)。双光子显微成像技术是近些年发展起来的结合了共聚焦激光扫描显微镜和双光子激发技术的一种新型非线性光学成像方法,采用长波激发,能对组织进行深层次成像。常用的比较好激发波长大多位于800-900nm,而水、血液和固有组织发色团对这个波段的光吸收率低,此外散射的激发光子不能激发样品,因此背景第,光损伤小,适用于在体检测。双光子荧光成像技术能准确定位细胞内置入的微电极位置,从而观察胞体、树突甚至单个树突棘的活性。研究者可完整的观察神经组织的分辨荧光图像,甚至可以分辨神经细胞单个树突棘中的钙分布。国外布鲁克双光子显微镜光子探测